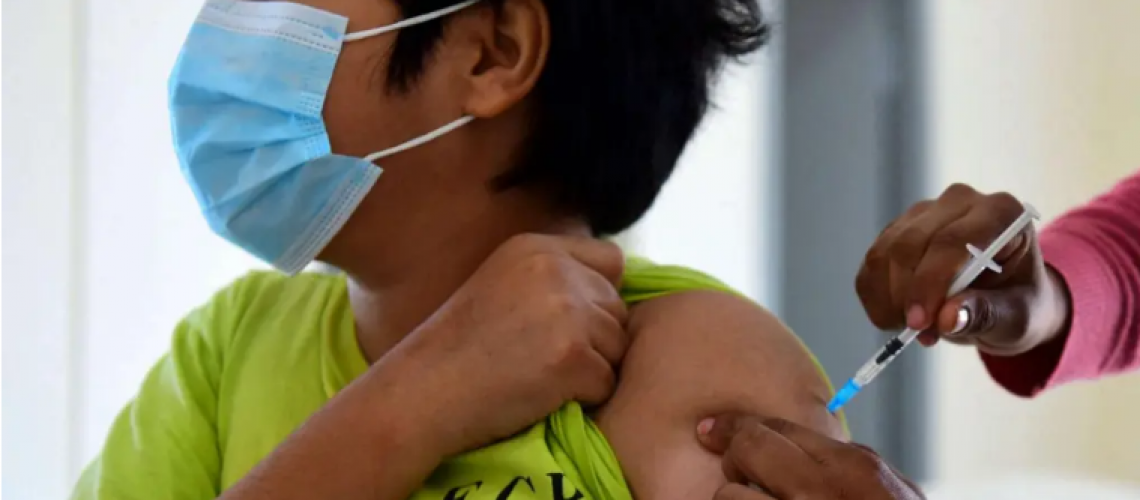
CNN.- Pfizer y BioNTech informaron este jueves que están solicitando la autorización de uso de emergencia de la Administración de Alimentos y Medicamentos de Estados Unidos para su vacuna contra el COVID-19 para niños de 5 a 11 años.
Si la autorizan, esta sería la primera vacuna contra el COVID-19 para niños más pequeños. La vacuna Pfizer / BioNTech está aprobada para personas de 16 años o más y tiene una autorización de uso de emergencia para personas de 12 a 15 años.
El mes pasado, Pfizer publicó detalles de un ensayo de fase 2/3 que mostró que su vacuna contra el covid-19 era segura y que generó una respuesta de anticuerpos “robusta” en niños de 5 a 11 años.
El ensayo incluyó a 2 mil 268 participantes de 5 a 11 años y utilizó un régimen de dos dosis de la vacuna administrada con 21 días de diferencia. Este ensayo utilizó una dosis de 10 microgramos, menor que la dosis de 30 microgramos que se ha utilizado para los mayores de 12 años.
Las respuestas inmunitarias de los participantes se midieron observando los niveles de anticuerpos neutralizantes en su sangre y comparando esos niveles con un grupo de control de personas de 16 a 25 años que recibieron un régimen de dos dosis con la dosis más grande de 30 microgramos. Pfizer dijo que los niveles se comparan bien con los de las personas mayores que recibieron la dosis mayor, lo que demuestra una “fuerte respuesta inmunitaria en esta cohorte de niños un mes después de la segunda dosis”.
Pfizer comenzó a enviar los datos a la FDA a fines del mes pasado, pero hasta ahora no había solicitado autorización formalmente.
Niños de entre 3 y 11 años podrán aplicarse la vacuna Sinopharm
Los funcionarios de la FDA habían dicho que una vez que se presentaran los datos de la vacuna para niños más pequeños, la agencia podría autorizar una vacuna para niños más pequeños en cuestión de semanas, no meses, pero dependería del momento y la calidad de los datos proporcionados.
Anticipándose a la solicitud, la FDA programó una reunión de su Comité Asesor de Vacunas y Productos Biológicos Relacionados para discutir la vacuna en niños de 5 a 11 años el 26 de octubre. Si la FDA lo aprueba, un panel de asesores de vacunas de los CDC se reunirá para considerar si recomendar su uso.
“Sabemos por nuestra vasta experiencia con otras vacunas pediátricas que los niños no son adultos pequeños, y realizaremos una evaluación integral de los datos de ensayos clínicos presentados para respaldar la seguridad y eficacia de la vacuna utilizada en una población pediátrica más joven, que puede necesitar una dosis o formulación diferente a la que se usa en una población pediátrica de edad avanzada o en adultos”, dijo la comisionada interina de la FDA, Janet Woodcock, en un comunicado sobre la reunión del 26 de octubre.